※ 元素記号をクリックすると元素の詳細が表示されます。
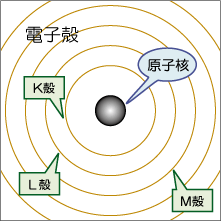
原子 原子は、中心に正の電荷を持つ原子核とその周りを飛び回っており負の電荷を持つ電子からできています。原子核は正の電荷を持った陽子と電荷を持たない中性子からできています。その、原子核中の陽子数を原子番号といいます。原子核の周りを回る電子の道筋(正確には電子の動き回るところ)を電子軌道と呼びます。電子は、軌道が平面ではなく球状で立体的なのでその軌道を殻(電子殻)とも呼んでいます。 周期番号
電子配置
族番号 族番号の1の位の数字が最外殻電子数を示します。以前、典型元素にAと遷移元素にBをつけて区別していたが、1989年に国際純正応用化学連合会(IUPAC)の無機化学命名法の改訂にともなって周期表の族の名称,番号の表記方法が1〜18族に改められられた。アメリカでは今でも区別している。同族の原子では、周期が大きくなるほど外側の電子殻に電子が入るため原子半径は大きくなります。 典型金属元素 金属元素のうち、遷移金属の系列にない物です。典型元素は、電子が最外殻に配置されていきます。つまり、電子が最外殻の軌道(s軌道,p軌道) に順次配置され金属としての特有の性質を持します。 典型非金属元素 非金属とは、その名の通り「金属ではない」という意味です。したがって、ここに分類される元素は金属結合を行わず金属に特有の性質を持ちません。単体では、気体である物が半分ぐらいあり電導性を持ちません。(炭素などの例外はある)典型元素は、電子が最外殻に配置されていきます。 遷移金属元素 遷移元素は全て金属元素です。遷移元素は、電子が最外殻に配置されずに内側の軌道(d軌道,f軌道)配置されていきます。遷移元素のうち、電子が 4f軌道に配置されていくものをランタノイド、5f軌道に配置されていくものをアクチノイドといいます。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||